Evrogen社 細胞内センサー蛍光タンパク質発現ベクター

Evrogen社の細胞内のカルシウムイオンや過酸化水素の濃度変化を感知する蛍光タンパク質発現ベクターを紹介します。
Calcium ion sensor Case12(カルシウムイオンインジケーター)
pCase12-cytoは、カルシウムイオン濃度の変化に応じて蛍光強度が変化する性質を有するCase12タンパク質を発現するベクターです。本製品は、さまざまな生理・病的な条件下で、生細胞におけるカルシウムイオン濃度の変化をモニタリングする際に最適です。
特長
- 高ダイナミックレンジのカルシウムインジケーター
- 細胞内で直接発現
- 補因子・基質は不要、その他、薬品を用いた染色も不要
- 高選択性かつ高感度
- 高輝度の蛍光でカルシウムイオン濃度変化に応答
- 生理的条件下のpHにおいても高輝度
性質
| 蛍光色 | グリーン |
|---|---|
| Excitation max | 491nm |
| Emission max | 516nm |
| 特異性 | カルシウムイオン |
| Kd for Ca2+ | 1μM |
| pKa | 7.2 |
| 分子量 | 46.4 kDa |
| ポリペプチド鎖長 | 415 aa |
| 構造 | モノマー |
| 凝集性 | なし |
| 37℃での成熟 | 迅速 |
pCase12-cytoベクターの構造
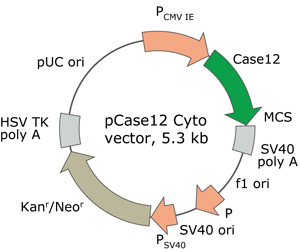
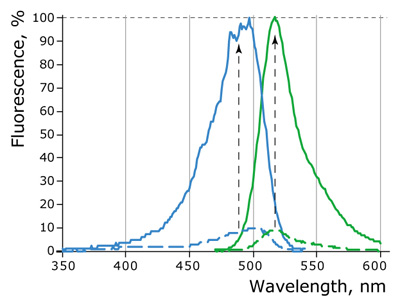
図1:Case12のEx/Emデータ
Case12のカルシウムイオン存在、非存在下において標準化したEx/Emデータ(点線:非存在下、実線:1mM Ca2+存在)。Case12は、1mM Ca2+に応答し、蛍光強度が数倍上昇した。
データ集
イオノホアとEGTAを用いたカルシウムイオンに対するCase12の応答
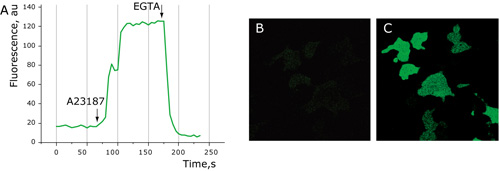
図2:HeLa細胞における最大のダイナミックレンジ
Case12ベクターをトランスフェクションしたHeLa細胞は、比較的弱いグリーン色の蛍光を示す(図2B)。20μMのカルシウムイオノホアA23187を添加(培地中のカルシウムイオン濃度:2mM)することにより、蛍光強度が5-6倍程度上昇した(図2AおよびC)。20mM EGTAを添加することで、Ca2+が除去され、蛍光シグナルがベースラインのレベルまで低下した(図2A)。
共焦点実験条件
Leica microscope DM IRE2, confocal TCS-SP2, objective HCX-PL-APO-63x/1.40-0.60/OIL.
Case12の蛍光強度とpHの関係
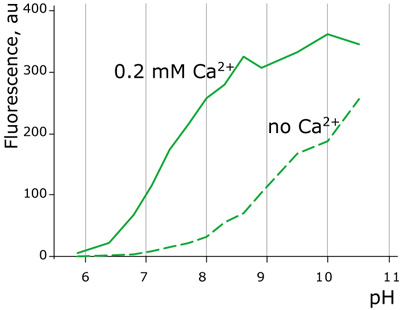
図3:カルシウムイオンの存在および非存在下におけるCase12蛍光のpH依存性
従来のカルシウムセンサーは、低pH側における安定性が問題点とされてきた。汎用的なPericamのpKa(蛍光強度が最大蛍光強度の50%となるpH)は、8.0に達する。一方、Case12のpKaは、7.2(10μMのカルシウムイオン存在下)であり、G-CaMPの値に匹敵する。この比較的高いpH安定性は、Case12がin vivoでの使用においても適した性質を有することを示している。
Case12のカルシウムイオンに対するKd値
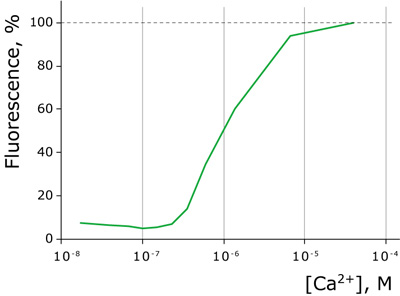
図4:カルシウムイオンタイトレーションカーブ
Case12のカルシウムイオンに対するKd値は、生理的なカルシウムイオン濃度内の1μMである。
生理的条件下におけるカルシウムイオン濃度のモニタリング
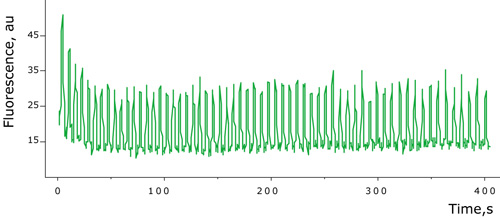
図5:生理的条件下におけるカルシウムイオン変化のモニタリング
最終濃度100μMのATPを添加した条件下、Case12を発現する哺乳類細胞は、高ダイナミックレンジで、カルシウムイオンの濃度変化に応答した。この実験により、カルシウムイオン振動に対するCase12の蛍光応答は、迅速かつ可逆的であることが示されている。また、Case12は、生細胞において、nMレンジでカルシウムイオン濃度変化に応答することが証明された。
文献
1. Souslova et al. BMC Biotechnology, 7, 37 (2007).
2. Nagai et al. Proc Natl Acad Sci USA, 98, 3197-3202 (2001).
3. Nakai et al. Nat Biotechnol, 19, 137-141 (2001).
価格表
H2O2 sensor HyPer(過酸化水素インジケーター)
pHyPer-cyto、pHyPer-dMitoは、過酸化水素濃度の変化に応じて蛍光強度が変化する性質を有するHyPerタンパク質を発現するベクターです。本製品は、生細胞における過酸化水素の特異的なモニタリングに最適な蛍光タンパク質発現ベクターです。
特長
- 細胞内過酸化水素のレシオ測定
- 過酸化水素の特異的な検出が可能
- 細胞内で直接発現
- 外来性の化合物や補因子不要
- 高選択性かつ高感度
- ROS(活性酸素)アーチファクトの産生なし
性質
| 製品名 | メーカー 製品番号 | 用途 |
|---|---|---|
| pHyPer-cyto | FP941 | 哺乳類細胞の細胞質内でのHyPerの発現 |
| pHyPer-dMito | FP942 | 哺乳類細胞のミトコンドリアでのHyPerの発現 |
pHyPer-cytoベクターの構造
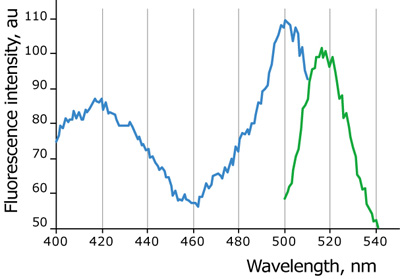
図1:HyPerのEx/Emデータ
Ex(図中、青色)、Em(図中、緑色)
データ集
Apo2L/TRAILを用いたアポトーシス誘導後の細胞質・ミトコンドリア内の過酸化水素産生の可視化
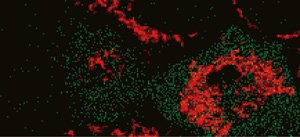
図2:Apo2/TRAILによるアポトーシス誘導時の細胞質イメージング
アポトーシス誘導中におけるHeLa細胞の細胞質発現型HyPer(緑色)とTMRM(赤色)の蛍光イメージ
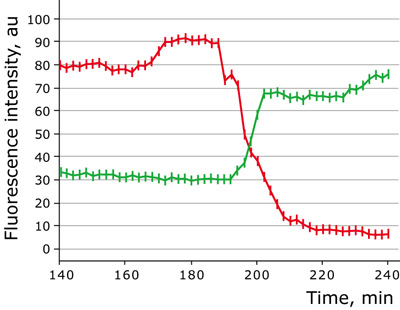
図3:Apo2/TRAILによるアポトーシス誘導時の蛍光強度変化
アポトーシス誘導中におけるHeLa細胞の細胞質発現型HyPer(緑色)とTMRM(赤色)の蛍光強度の変化
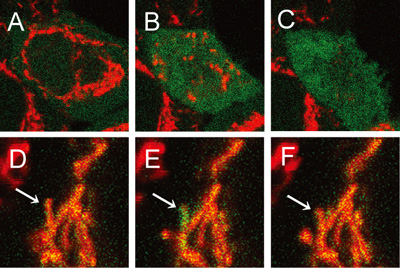
図4:Apo2/TRAILによるアポトーシス誘導時の細胞質およびミトコンドリアのイメージング
アポトーシス誘導中のHeLa細胞の細胞質(A-C)およびミトコンドリア(D-F)のHyPer(緑色)とTMRM(赤色)の蛍光イメージ
(A-C):処理後、(A) : 176min、(B) : 200min、(C) : 240min
(D-F):アポトーシスの間に一時的に脱分極したミトコンドリア内での過酸化水素レベルの上昇
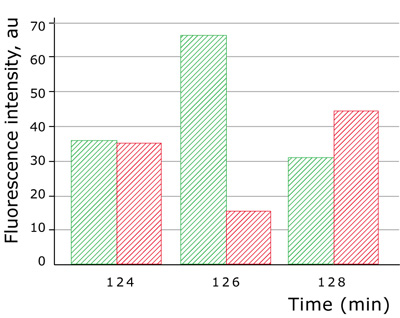
図5:Hyper(緑色)およびTMRM(赤色)の蛍光強度
ミトコンドリア発現型HyPer(緑色)とTMRM(赤色)を用いたミトコンドリアの過酸化水素レベルと膜電位変化の解析
Apo2/TRAILによる誘導(図2-5)
①Apo2L/TRAIL(400ng/ml)でアポトーシス誘導を行うと、HeLa細胞の分解が観察された。処理後、3時間で細胞の形態は、平らな形状から原形質膜ブレブを形成し、円形の形態へと変化した。HyPer-cytoおよびTMRMを用いた結果、細胞質過酸化水素がミトコンドリアの膜電位の消失および細胞の形態変化と応答して、細胞質の過酸化水素が上昇することを確認した(図2、図3、図4A-C)。
②Apo2L/TRAIL処理したHeLa細胞のミトコンドリアにおける過酸化水素レベルの変化を調査するために、ミトコンドリアをターゲットとしたHyPerを使用した。処理後、1-2時間で、一部のミトコンドリアの膜電位が振動し始めた。一部のミトコンドリアは、膜電位の修復に従い一過性の消失を示した。脱分極したミトコンドリアでは過酸化水素レベルの上昇が確認された一方で、ミトコンドリアの膜電位の修復は、過酸化水素レベルの低下へと誘導した(図4D-F、図5)。
共焦点実験条件
図2-5:Changes in HyPer fluorescence were followed upon excitation by 4% intensity 488-nm light (emission at 500-520 nm) with simultaneous visualization of TMRM fluorescence upon excitation by 12% intensity 543 nm light (emission at 600-650 nm). Leica confocal system TCS SP2 on inverted microscope Leica DM IRE equipped with HCX PL APO lbd.BL 63x 1.4NA oil objective and 125 mW Ar and 1 mW HeNe lasers was used. Scanning was performed using 400 Hz line frequency, 512x512 format. Time series speed was 1 frame per 2 minutes.
Nerve Growth Factor(NGF)を用いた低レベル過酸化水素の検出
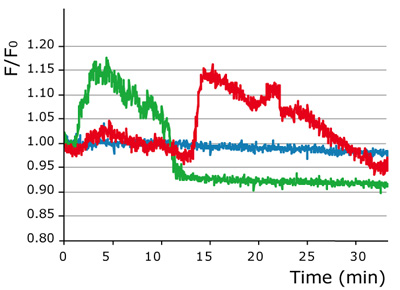
図6:NGF刺激後の蛍光強度変化
NGF刺激後の細胞質発現型HyPerが過酸化水素応答に対して示す2種類のタイムコース(緑色および赤色)と未処理の細胞(青色)のタイムコース
NGFによる誘導(図6)
生理的な刺激により産生される低レベルの過酸化水素を検出するために、細胞質にHyPerを発現するPC-12細胞に対して、NGF処理を施した(同様の実験を4つ展開し、それぞれ22個の細胞について解析)。大半の細胞で、NGF添加後直ぐに過酸化水素レベルが上昇した。添加後、3-7分で最大値に到達し、10-20分で初期レベルへと減少した。また、ある種の細胞は、過酸化水素上昇に関して、Biphasic Kineticsを示した。このような細胞は、微量な初期の一過性の過酸化水素の上昇、引き続いてより高い過酸化水素レベルの上昇が生じ、急速な過酸化水素の上昇が生じた。後にHyPerの蛍光強度は初期レベルに到達した。
共焦点実験条件
図6:Changes in HyPer fluorescence were followed upon excitation by 4% intensity 488-nm light (emission at 500-520 nm). Leica confocal system TCS SP2 on inverted microscope Leica DM IRE equipped with HCX PL APO lbd.BL 63x 1.4NA oil objective and 125 mW Ar lasers was used. Scanning was performed using 400 Hz line frequency, 512x512 format. Time series speed was 1 frame per 3 seconds.
文献
1. Belousov et al. Genetically encoded fluorescent indicator for intracellular hydrogen peroxide. Nat Meth. 3(4), 281-286 (2006).
2. Choi et al. Structural basis of the redox switch in the OxyR transcription factor. Cell, 105, 103-113 (2001).
3. Gorman C. High efficiency gene transfer into mammalian cells. In DNA cloning: A Practical Approach, Vol. II. Ed. D. M. Glover. (IRL Press, Oxford, U.K.), 143-190 (1985).
価格表
Notice to Purchaser
These products related materials (also referred to as“Products”) are intended for research use only. Some elements of this material may be covered by third party patents issued and applicable in certain countries. No license under these patents is conveyed expressly or by implication to the recipient of the materials. Users of these materials may be required to obtain a patent license depending upon the particular application and country in which the materials are received or used.
CMV Promoter
The CMV promoter is covered under U.S. Patents 5,168,062 and 5,385,839 and its use is permitted for research purposes only. Any other use of the CMV promoter requires a license from the University of Iowa Research Foundation, 214 Technology Innovation Center, Iowa City, IA 52242.
※記載の内容は、'09年10月現在の情報に基づいております。

















