Annexin V-FITC Apoptosis Detection Kit
本製品はアポトーシスを検出するキットです。FITCで蛍光標識したアネキシンVとPIを利用し、初期のアポトーシスと後期のアポトーシスを検出することが可能です。
現在、本製品の40%Offキャンペーンを開催中です。詳細はこちらをご覧ください。
特長
- 簡便にアポトーシス初期、アポトーシス後期の観察が可能
- 細胞の固定は不要
- フローサイトメトリーまたは蛍光顕微鏡で検出可能
| 原理 | 実施例1 | 実施例2 | 性能比較 | 性能評価 | キット構成 | 試薬の調製 | 使用方法 |
原理
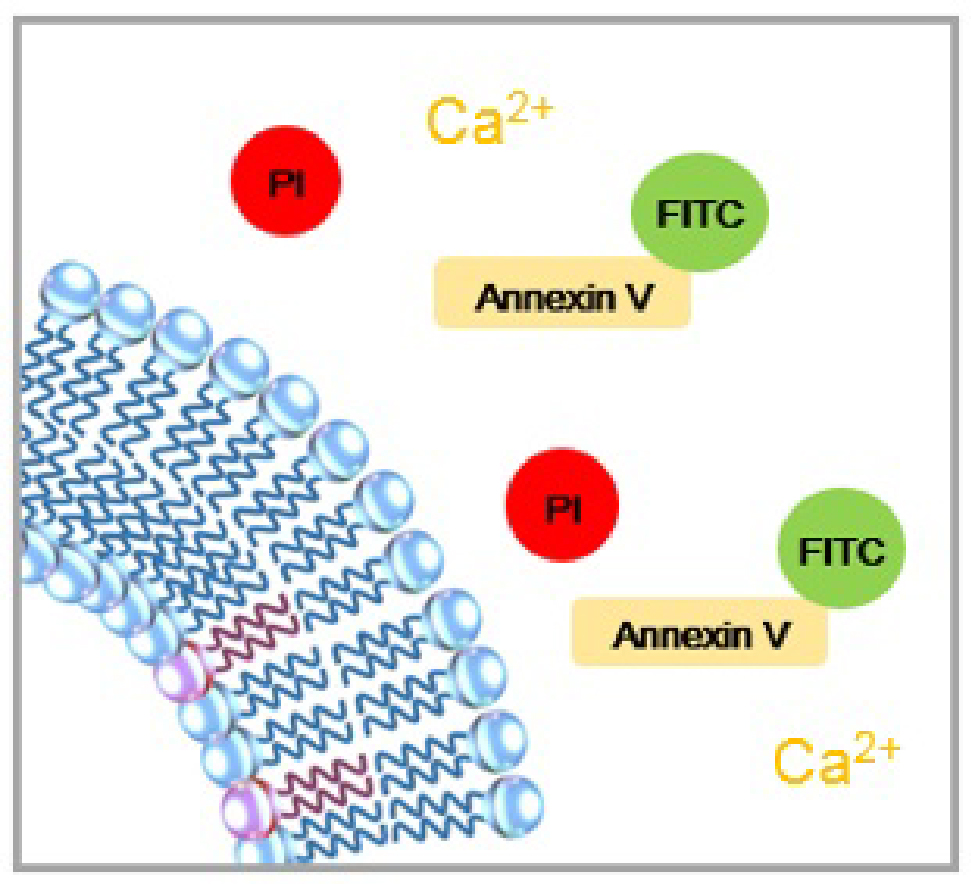
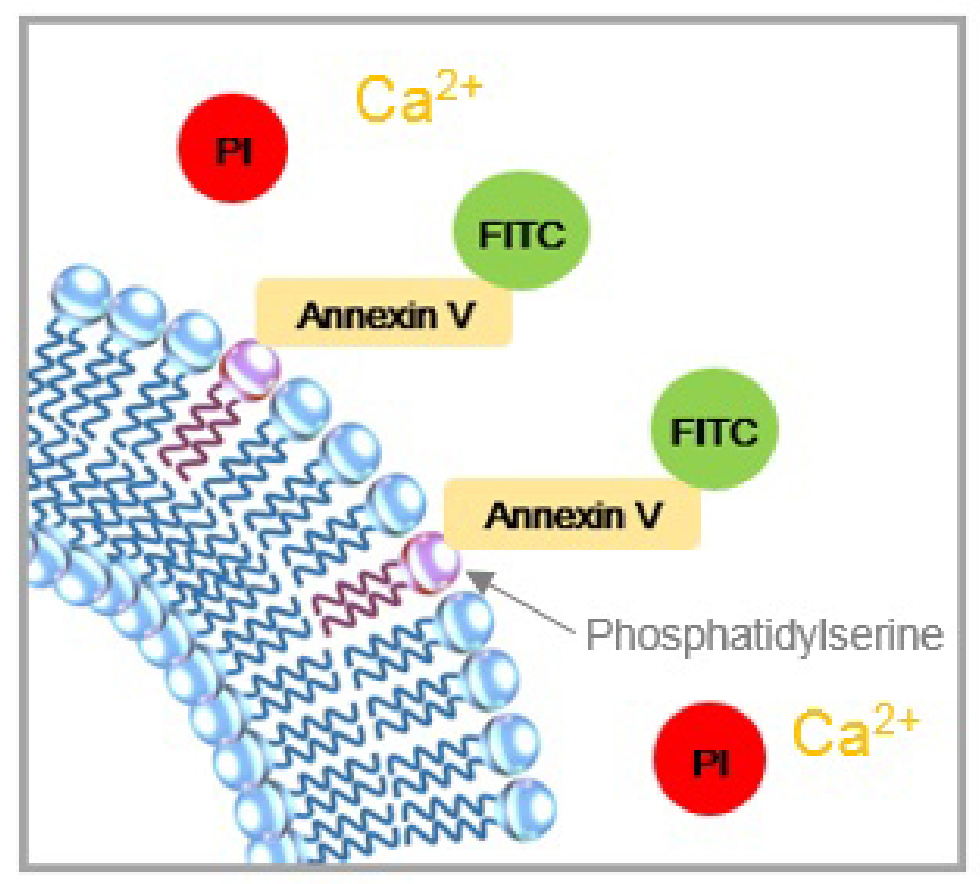
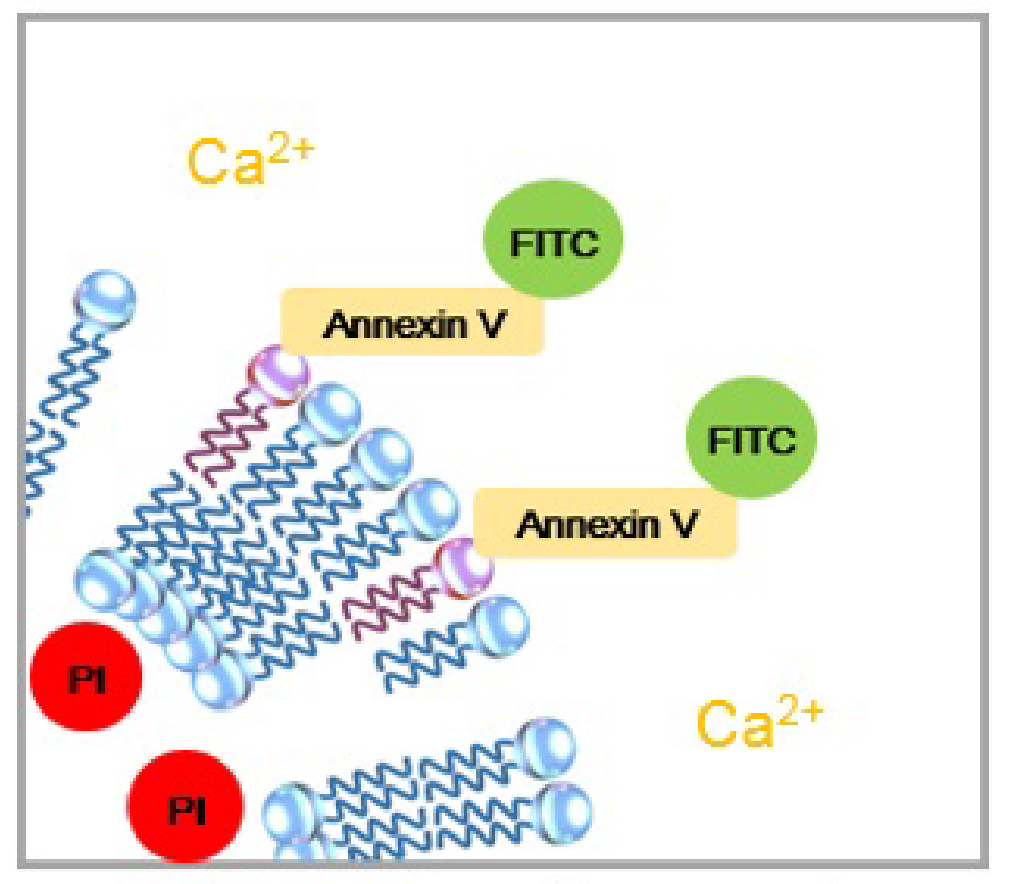
| 正常細胞 | アポトーシス初期 | アポトーシス後期 |
|---|---|---|
|
|
|
|
正常な細胞では、膜リン脂質であるホスファチジルセリン(PS)が細胞膜の内側に存在するため、アネキシンVは認識されません。アポトーシス初期の細胞では、細胞膜構造は維持したまま、PSが細胞表面に露出してくるため、FITC標識アネキシンVに認識されて細胞表面だけが緑(FITC)に染色されます。アポトーシス後期の細胞では、細胞内にPIが取り込まれるようになり、細胞内が赤(PI)に染色されます。
実施例1
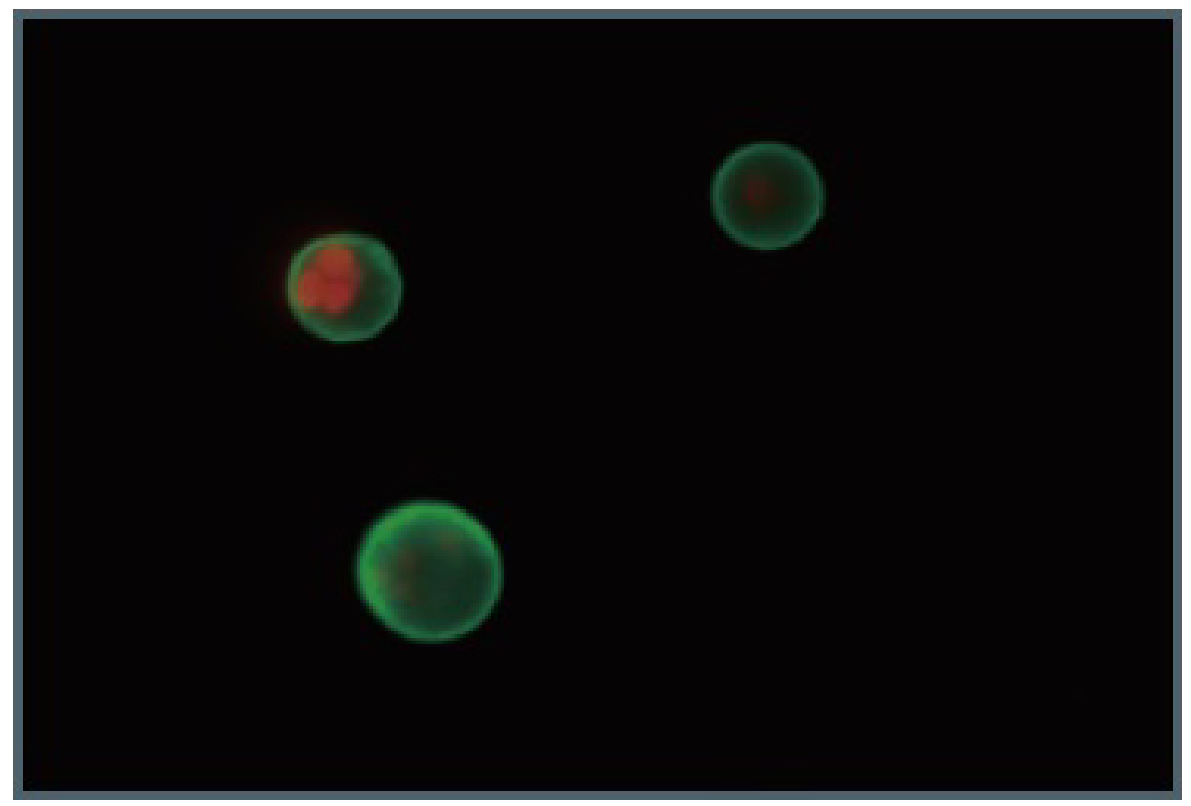
■アポトーシス誘導細胞の蛍光画像
| 明視野観察 | 蛍光観察 |
|---|---|
|
|
|
Jurkat細胞に1μg/mlのスタウロスポリンを37℃で3.5時間作用させてアポトーシスを誘導し、蛍光顕微鏡で観察した。
FITC標識アネキシン(緑)
PI(赤)
実施例2
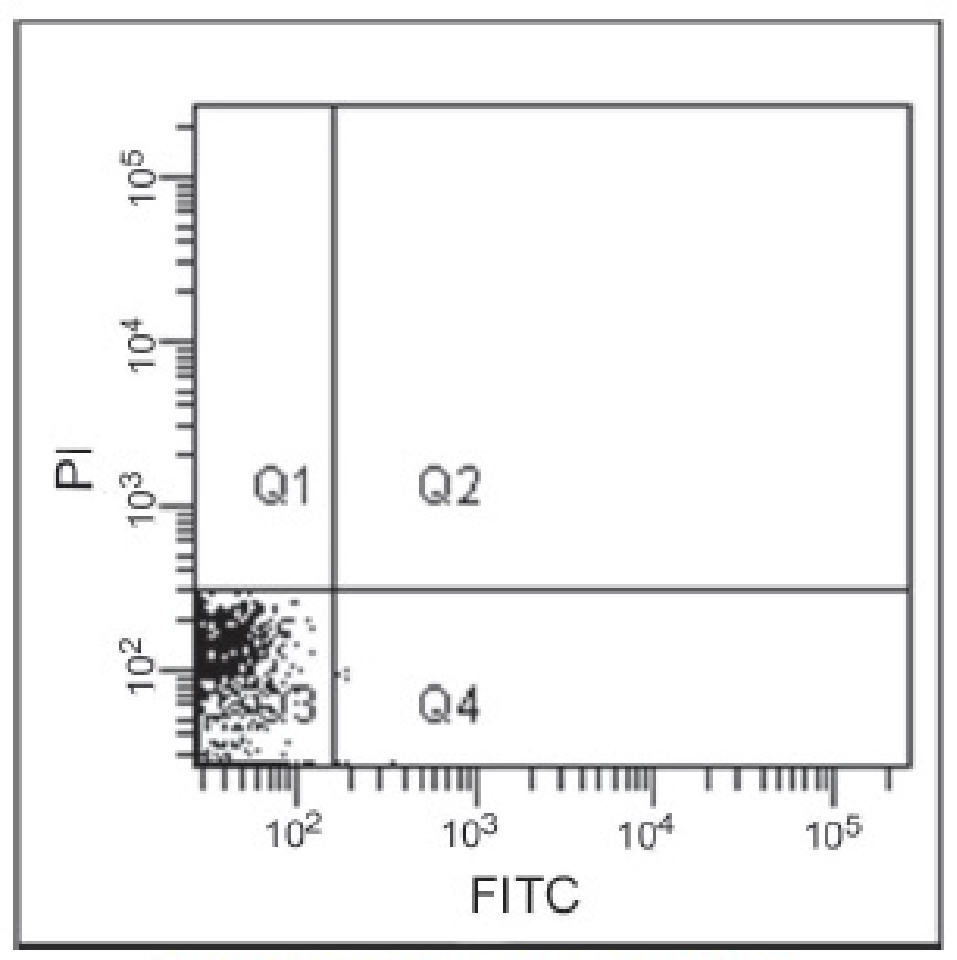
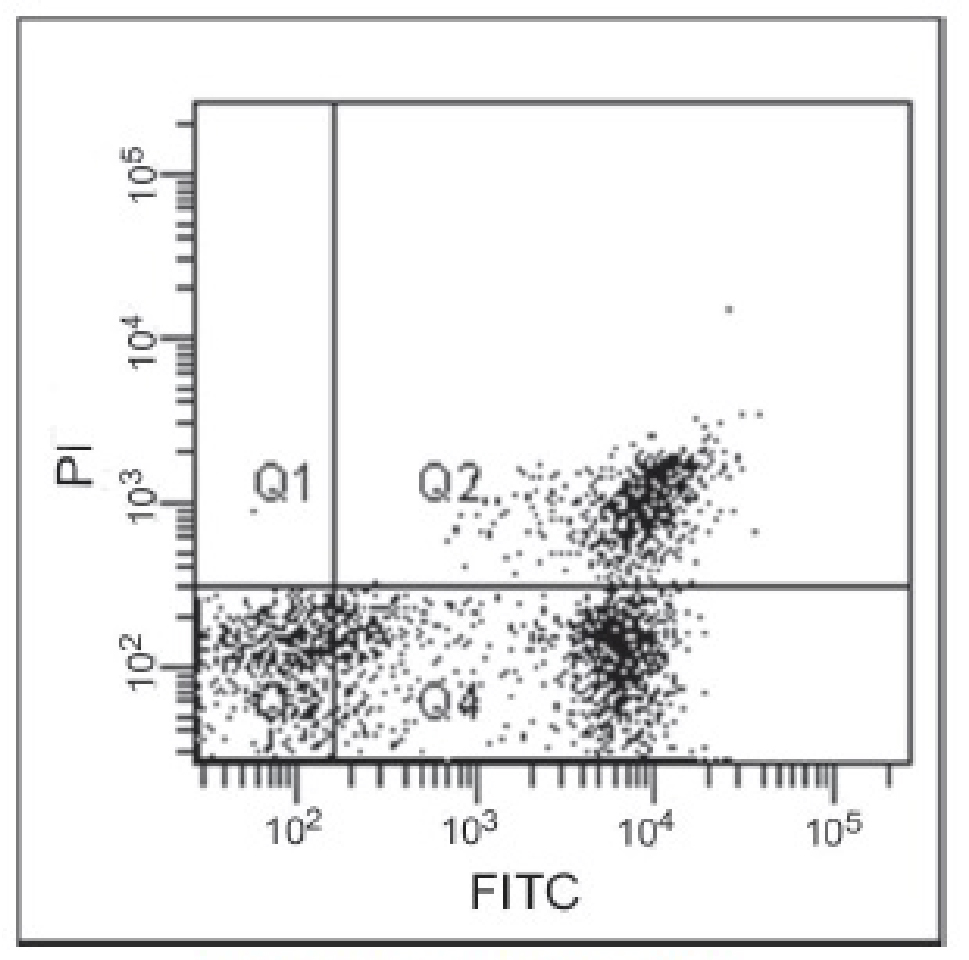
■アポトーシス誘導細胞のフローサイトメトリー解析
| コントロール(未処理) | アポトーシス誘導細胞 |
|---|---|
|
|
|
Jurkat細胞に1μg/mlのスタウロスポリンを37℃で3.5時間作用させてアポトーシスを誘導し、フローサイトメーターで解析した。
性能比較
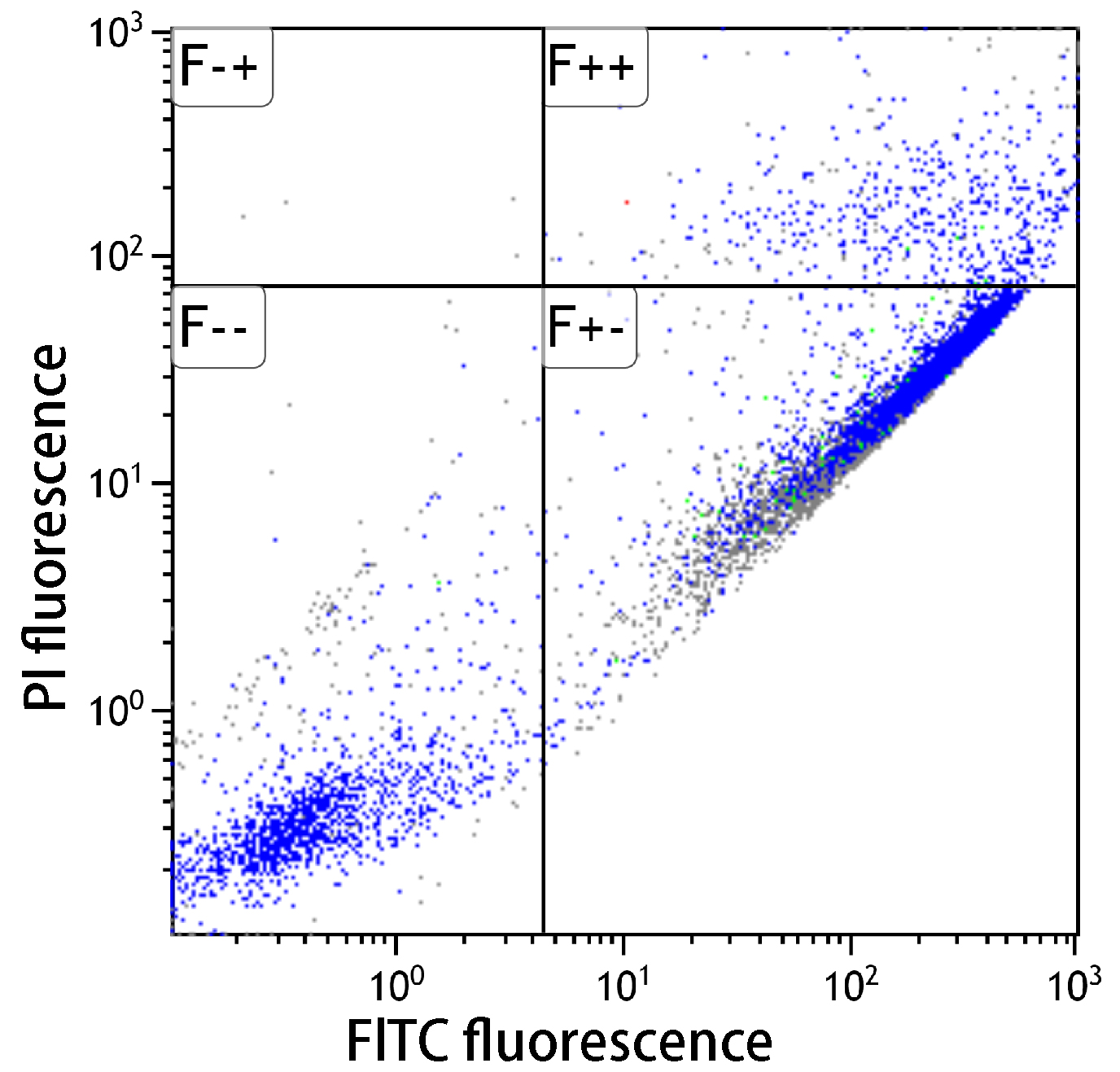
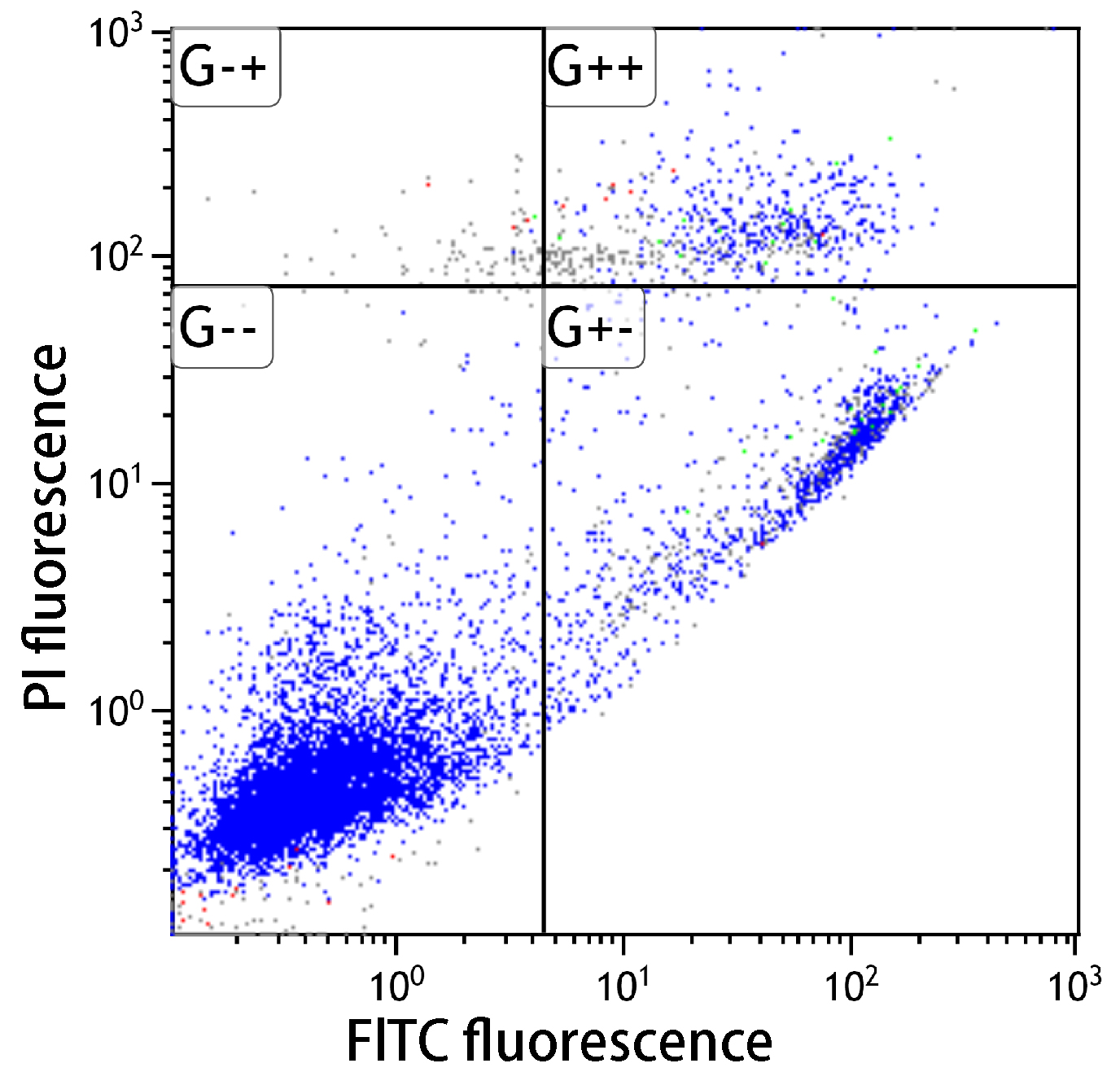
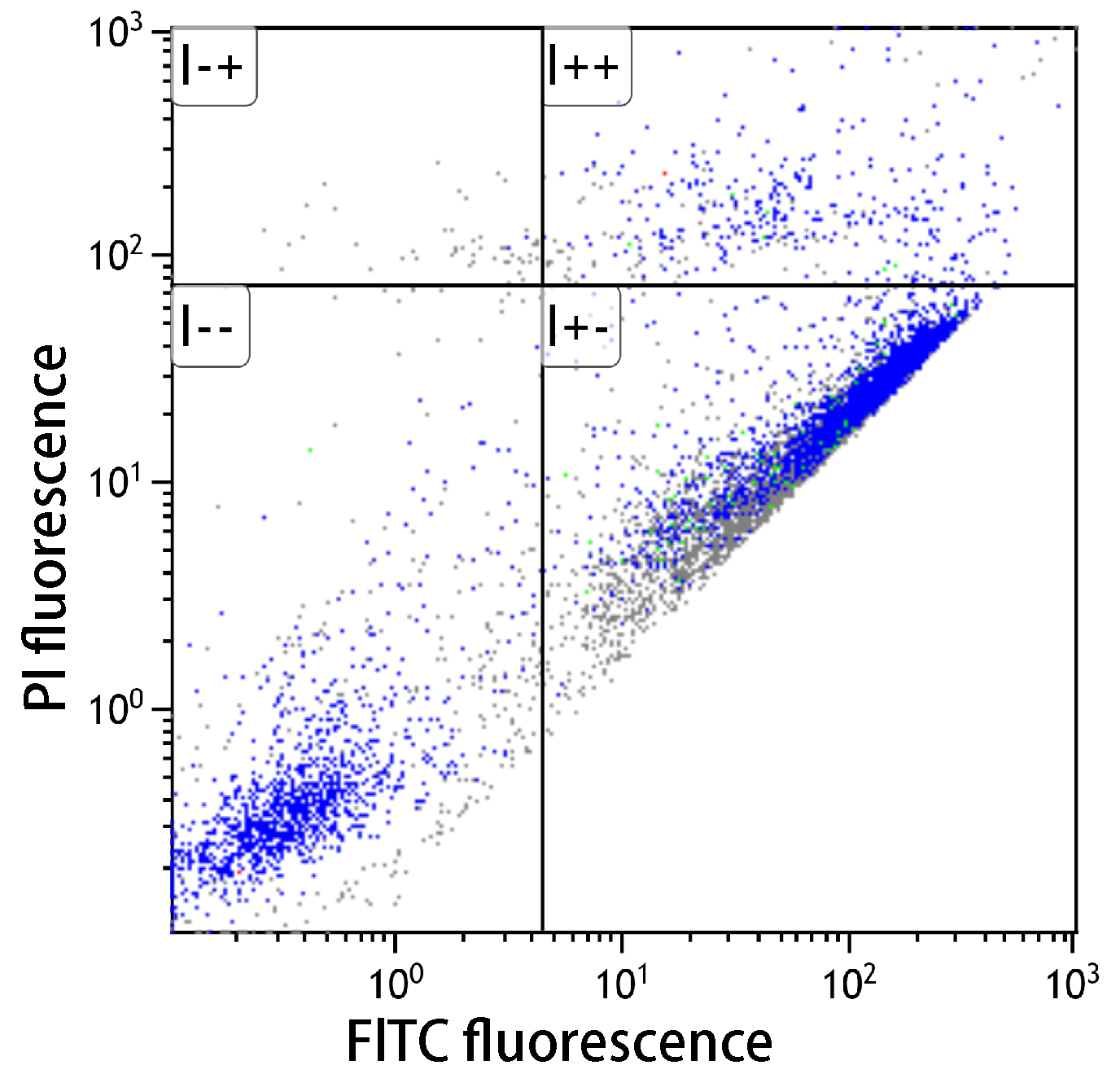
■アポトーシス検出キット性能比較
| コントロール(未処理) | シクロヘキシミド処理 | UV処理 | |
|---|---|---|---|
| A社製品 | 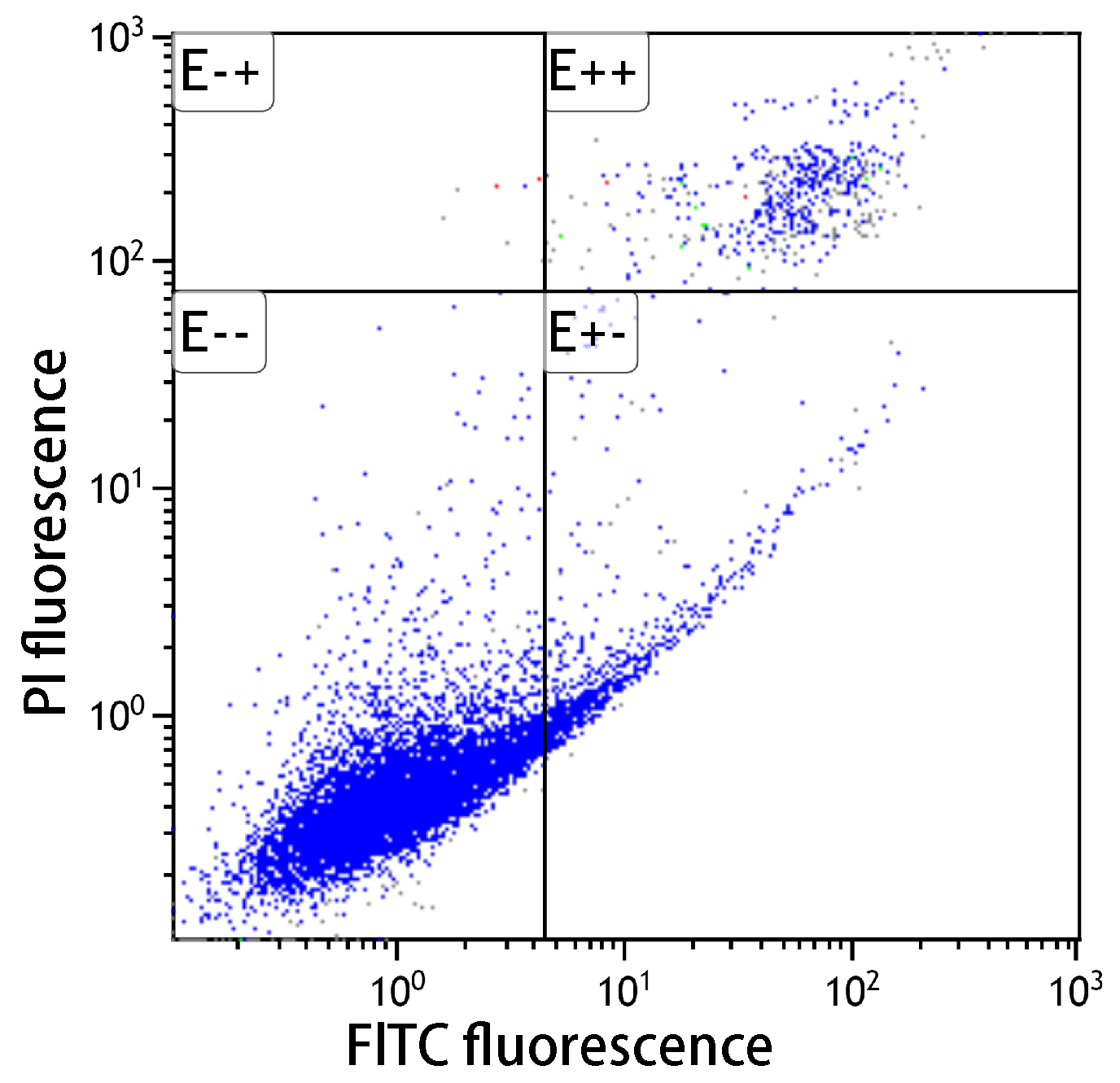 |
 |
 |
| 自社品 | 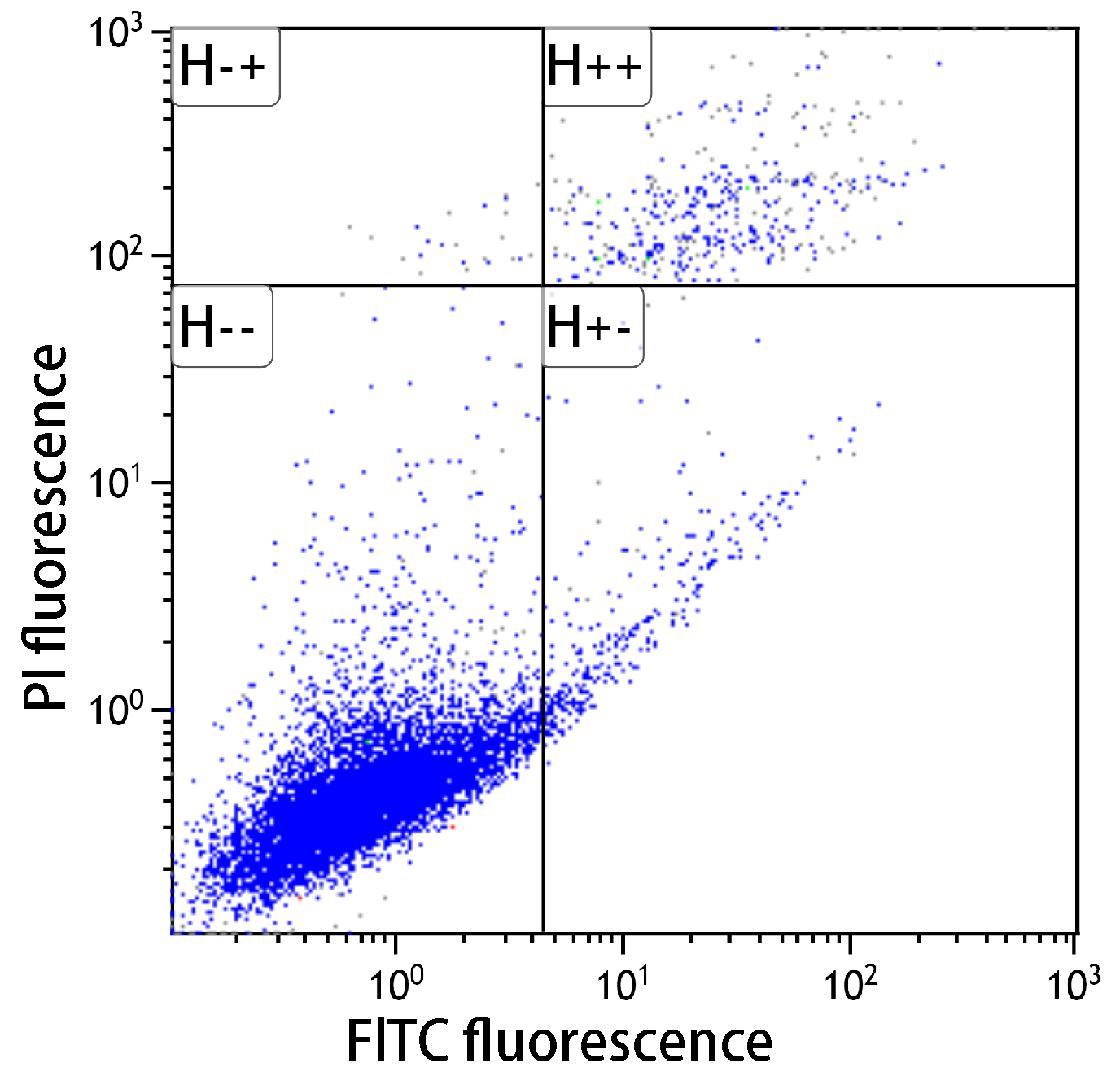 |
 |
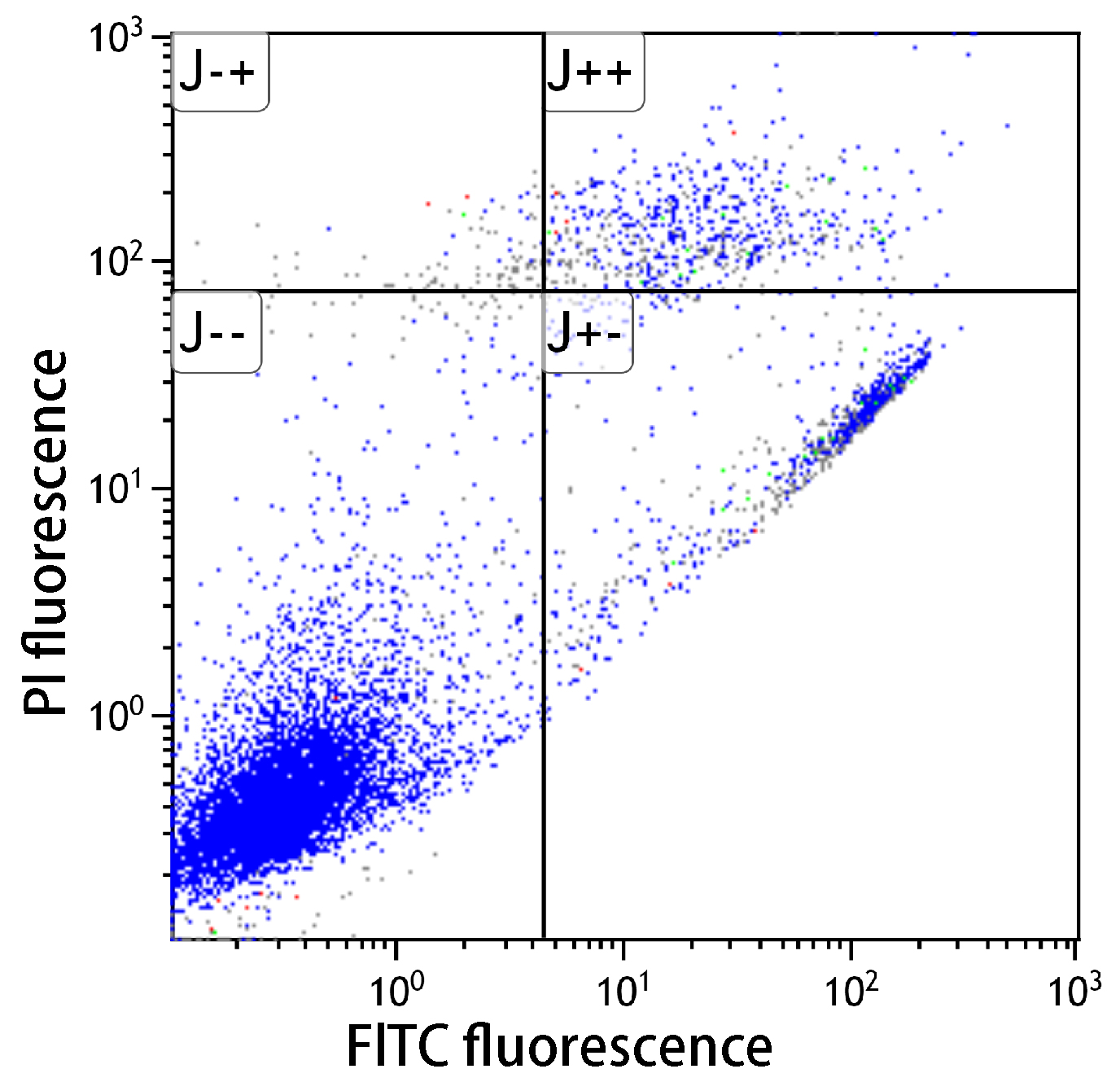 |
細胞種:マウスB16メラノーマ細胞
細胞数:10,000個
検出装置:Gallios(ベックマン・コールター社)
シクロヘキシミドおよびUV照射(1μg/ml)によりアポトーシスを誘導し(37℃、3.5時間)、フローサイトメーターで解析したところ、本キットはA社製品と同等の性能を有していることを示した。
未処理においては、アポトーシスは認められなかった。シクロヘキシミドでアポトーシスを誘導すると、アポトーシス初期の細胞が多数確認できた。またUV処理した細胞でもアポトーシスが確認できた。
-- : FITC標識アネキシンVおよびPIの双方共に蛍光値が低い。生細胞領域。
+- : FITC標識アネキシンVの蛍光値は高く、PIは低い。アポトーシス初期。
++ : FITC標識アネキシンVおよびPIの双方共に蛍光値が高い。アポトーシス後期。
データご提供:京都大学大学院 薬学研究科 病態情報薬学
高橋 有己 助教
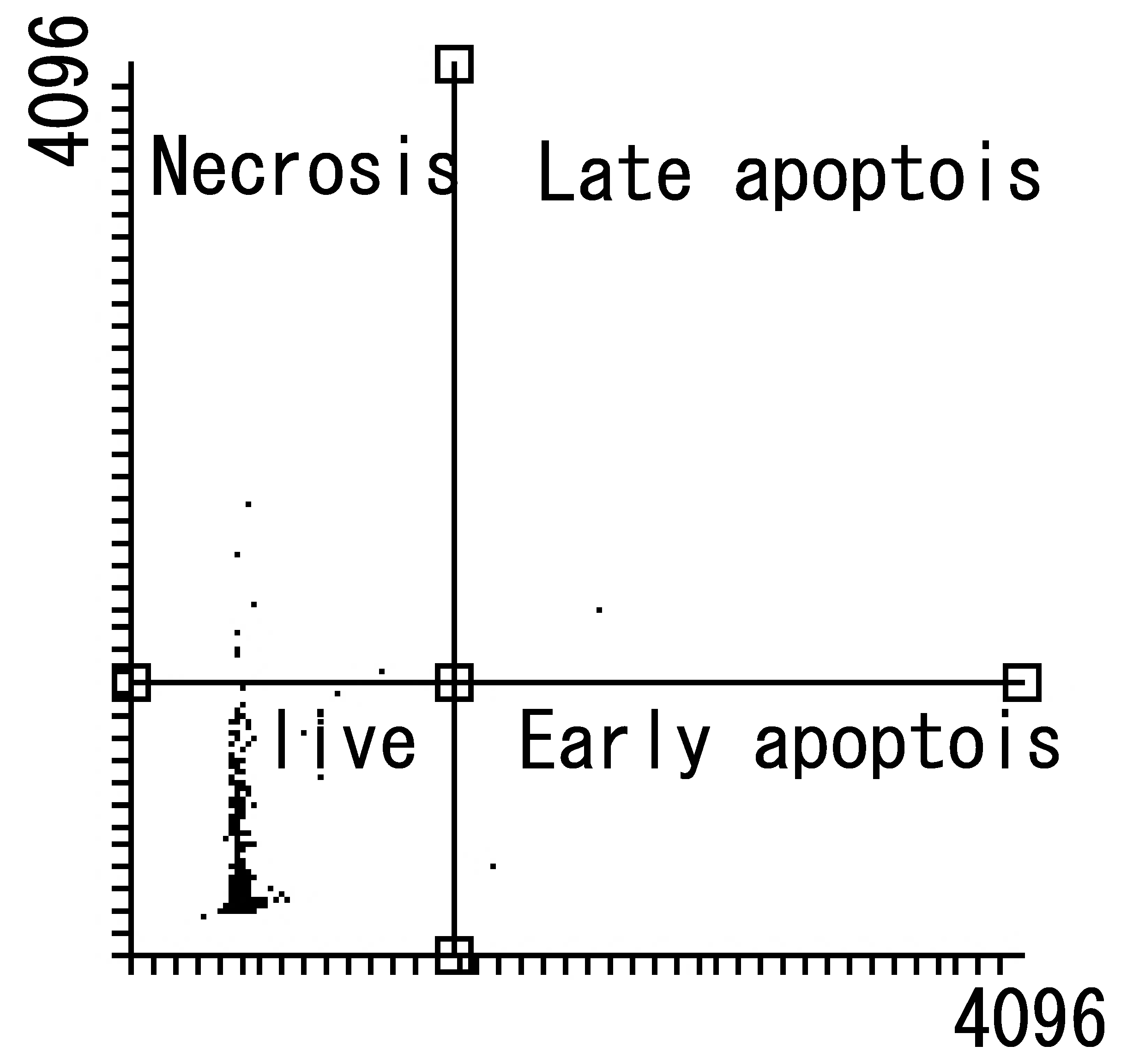
性能評価
■アポトーシス検出キット性能評価
グルコースを除き飢餓状態(48時間)によりアポトーシスを誘導し、イメージングサイトメーターで解析したところ、アポトーシス初期の細胞が確認できた。
| コントロール(未処理) | 飢餓状態(48時間) |
|---|---|
 |
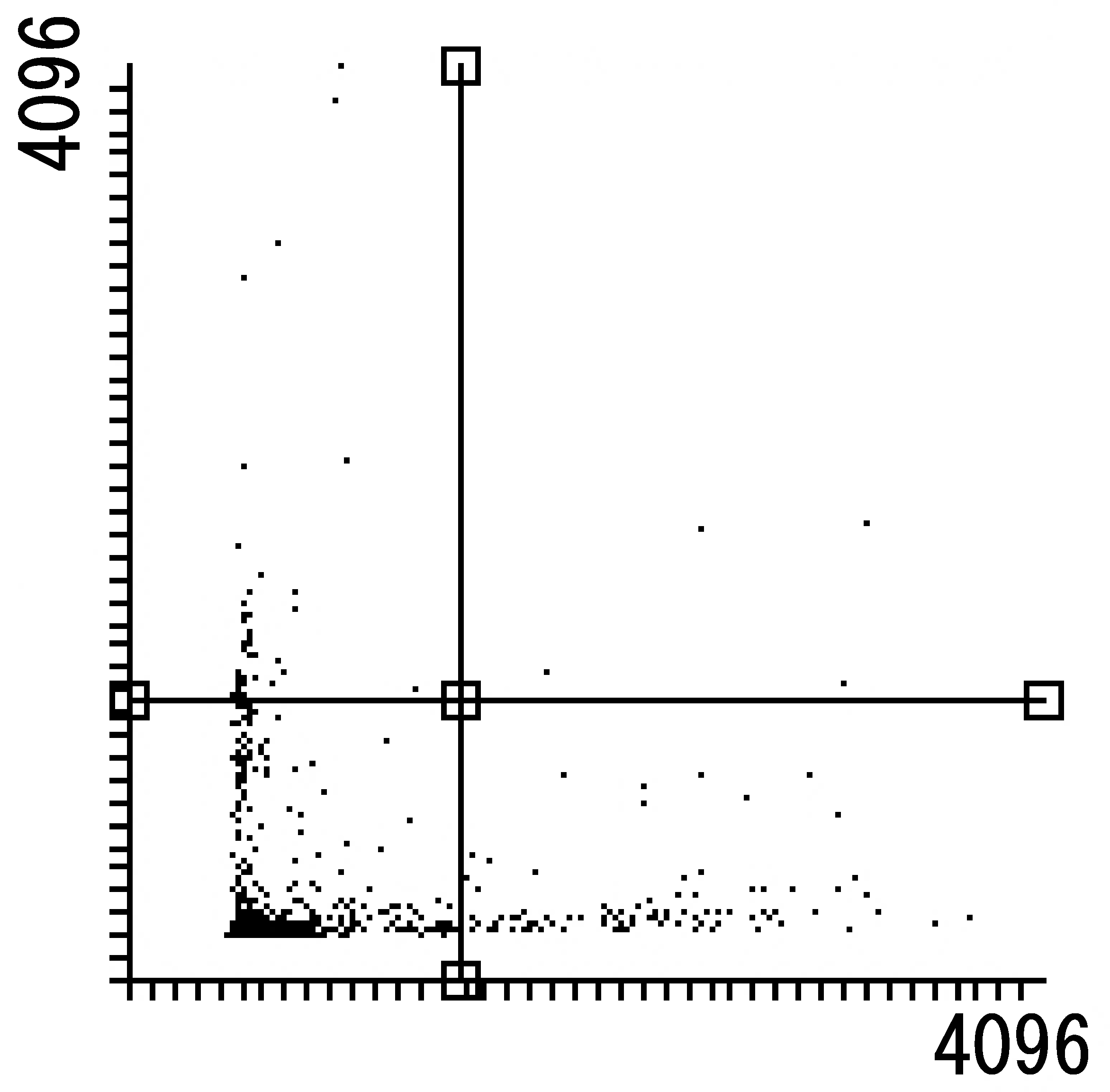 |
細胞種:U-87 MG 細胞
検出装置:Tali@イメージサイトメーター(サーモフィッシャーサイエンティフィック社)
データご提供:京都府立医科大学大学院 医学研究科 生体情報・機能形態学分野 神経発生生物学(生物学教室)
後藤 仁志 教授
キット構成
| 試薬名 | 容量 | 数量 |
|---|---|---|
| アネキシンV-FITC溶液 | 250μl | 2 |
| ヨウ化プロピジウム(PI)溶液 | 250μl | 2 |
| アネキシンV結合バッファー(10倍濃縮) | 10ml | 2 |
注)本製品は100回用です。
試薬の調製
■アネキシンV結合溶液(1×)の調製
アネキシンV結合バッファー(10倍濃縮)を超純水で10倍希釈します。
使用方法
■浮遊細胞
①細胞を回収し、PBSで2回洗浄します。
②アネキシンV結合溶液(1×)を用いて、最終細胞密度が1×106cells/mlとなるように細胞を懸濁します。
③新しいチューブに、細胞懸濁液を100μl移します。
④アネキシンV-FITC 溶液を5μl、次にPI溶液を5μl添加します。
⑤遮光して、室温で15分反応させます。
⑥アネキシンV結合溶液(1×)を400μl加え、ゆっくりと混合します。
⑦できるだけ早く、フローサイトメトリー、または蛍光顕微鏡で解析します。
■接着細胞
①培養液を除去します。
②PBSで細胞を2回洗浄します。
③トリプシン-EDTA溶液を用いて細胞を剥離します。
④適当量の培地、またはPBSで細胞を懸濁し、遠心用チューブに移します。
⑤遠心して細胞を回収します。
⑥細胞をPBSで2回洗浄します。
⑦アネキシンV結合溶液(1×)を用いて、最終細胞密度が1×106cells/mlとなるように細胞を懸濁します。
⑧新しいチューブに、細胞懸濁液を100μl移します。
⑨アネキシンV-FITC溶液を5μl、次にPI溶液を5μl添加します。
⑩遮光して、室温で15分反応させます。
⑪アネキシンV結合溶液(1×)を400μl加え、ゆっくりと混合します。
⑫できるだけ早く、フローサイトメトリー、または蛍光顕微鏡で解析します。
注)接着細胞は、細胞剥離操作時に特異的な細胞膜損傷を受けるため、アネキシンV-FITCのフローサイトメトリー解析には使われないこともありますが、Casiola-Rosenらやvan Engelandらにより、接着細胞を用いたフローサイトメトリーによるアネキシンVの検出方法が報告されています。
| excitation / emission | |
|---|---|
| FITC標識アネキシン V | 494 nm / 518 nm |
| PI | 535 nm / 617 nm |
1. Casciola-Rosen L, Rosen A, Petri M, Schlissel M, Proc Natl Acad Sci USA, 93(4), 1624 (1996)
2. van Engeland M, Remaekers FC, Schutte B, Reutelingsperger CP, Cytometry, 24(2), 131 (1996)
価格表
※記載の内容は、'16年6月現在の情報に基づいております。